12-20 22:52:45 浏览次数:268次 栏目:高考备考
As2O5与NaOH溶液反应的离子方程式是 。
② 上述混合液用0.02500 mol·L-1的I2溶液滴定,消耗I2溶液20.00 mL。滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000 mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00 mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)
试样中As2O5的质量是 g。
www.170xue.com26.(14分)
高铁酸钾(K2FeO4)具有很强的氧化性,是一种高效水处理剂。
(1)用K2FeO4处理废水时,既利用其强氧化性,又利用Fe(OH)3胶体的 作用。
(2)制备K2FeO4可以采用干式氧化法或湿式氧化法。
① 干式氧化的初始反应是2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中每生成2 mol Na2FeO4时转移电子 mol。
② 湿式氧化法的流程如下图:
上述流程中制备Na2FeO4的化学方程式是 。
结晶过程中反应的离子方程式是 。
(3)K2FeO4在水中不稳定,发生反应:4FeO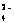 +10H2O
+10H2O 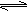 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。
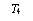
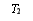
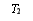
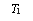
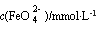
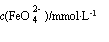
图ⅠK2FeO4的稳定性与温度的关系 图ⅡK2FeO4的稳定性与溶液pH的关系
① 由图Ⅰ可得出的结论是 。
②  图Ⅱ中a c(填“>”、“<”或“=”),其原因是 。
图Ⅱ中a c(填“>”、“<”或“=”),其原因是 。
27. (13分)
某化学小组同学用下列装置(气密性已检验)进行实验。

Ⅰ Ⅱ Ⅲ Ⅳ
(1)探究O2与KI溶液发生反应的条件。
① 甲、乙两同学选用以下试剂进行实验(0.1 mol·L-1 KI溶液,30% H2O2溶液、0.1 mol·L-1 H2SO4溶液、淀粉溶液、MnO2固体、KMnO4固体),实验记录如下。
| 操作 | 现象 | |
| 甲 | 向Ⅰ中加入必要的试剂,并向Ⅳ中加入KI、淀粉溶液。连接Ⅰ、Ⅳ,打开活塞 | Ⅰ中剧烈反应,产生无色气体并伴随大量白雾;Ⅳ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入必要的试剂,并向Ⅳ中加入KI、淀粉溶液和稀硫酸。连接Ⅱ、Ⅳ,点燃酒精灯 | Ⅳ中有气泡冒出,溶液变蓝 |
甲制取O2的化学方程式是 。
乙实验中O2与KI溶液反应的离子方程式是 。
www.170xue.com② 甲用Ⅱ加入试剂替换Ⅰ后,Ⅳ中仍加入KI、淀粉溶液,再次实验时Ⅳ中溶液不变蓝。由此他猜测第一次实验时可能是Ⅰ中的白雾使溶液变蓝。甲又将Ⅰ中产生的气体直接通入下列 溶液(填序号),证明了白雾中含有H2O2。
a. 酸性KMnO4 b. FeCl2 c. Na2S
③ 由甲、乙两同学的实验,可得出结论: 。
(2)资料显示:KI溶液在空气中被缓慢氧化时CO2参与了反应。丙、丁两同学为探究该反应中CO2的作用,进行下列实验。
| 操作 | 现象 | |
| 丙 | 向Ⅰ中加入Na2CO3和稀硫酸,Ⅳ中加入KI、淀粉溶液并在上层覆盖少量煤油。使Ⅰ中发生反应将装置中空气排尽后,再将气体通入Ⅳ的溶液中 | Ⅳ中有气泡冒出,溶液不变蓝 |
| 丁 | 向Ⅰ中加入Na2CO3和稀硫酸,Ⅲ中加入必要试剂,Ⅳ中加入KI、淀粉溶液。依次连接Ⅰ、Ⅲ、Ⅳ,打开活塞 | Ⅳ中有气泡冒出,溶液变蓝 |
① 丙实验的目的是 。
② 丁实验的Ⅲ中加入试剂的化学式是 。
③ 为证明CO2所起的作用,可进行的操作是:取上述丁实验后Ⅳ中溶液, 。
28.(17分)
有机物分子中与“”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应。
已知:
① ②
有机物J是重要的工业原料,其合成路线如下(部分产物和反应条件略):
(1)A中所含官能团的名称是 。
(2)A→B的反应类型是 反应。
(3)G俗称缩苹果酸,与B以物质的量之比1:2反应,则G+B→H的化学方程式是 。
(4)J的同分异构体X属于芳香族化合物,1 mol X与足量Na或NaOH反应时的物质的量之比分别是1:4和1:1,且苯环上只有一种一氯代物。符合上述条件的X有 种,写出其中任意一种的结构简式: 。
(5)已知E中只有一种官能团,且核磁共振氢谱显示其分子中有两种不同化学环境的氢。则下列说法正确的是 (填序号);E的分子式是 。
a.E与B互为同系物
b.E中含有的官能团是羟基
c.F在一定条件下也可转化为E
d.F中也有两种不同化学环境的氢
(6)J的结构简式是 。
,2017北京东城区高考化学一模试卷相关分类
高考备考 推荐